Der menschliche Organismus erzeugt aufgrund seines aeroben Stoffwechsels ständig reaktive Sauerstoff- und Stickstoffspezies (ROS = Reaktive Sauerstoffspezies, RNS = Reaktive Stickstoffspezies) und andere radikalische Moleküle auf kontrollierte Weise und inaktiviert sie mit Systemen, die in der Lage sind, die intrazelluläre Umgebung im Gleichgewicht zwischen schädlichen oxidierenden Radikalen und schützenden Antioxidationsmolekülen (endogen und exogen) zu halten. Die Selbstregulierung des Oxidations-Reduktions-Gleichgewichts des Körpers wird als „zelluläre Redox-Homöostase“ definiert.
Bei mitochondrialen oxidativen Phosphorylierungsprozessen werden 4–5 % des Sauerstoffs aus der Zellatmung nicht zu H2O reduziert und bilden hochreaktive Zwischenprodukte, d. h. Moleküle mit ungepaarten Elektronen. Durch ionisierende Strahlung (UV, X, Gamma), Medikamente und Xenobiotika (z. B. Chemotherapie wie Anthrazykline) werden Zustände von „oxidativem Stress“ erzeugt, die auf eine erhöhte Produktion von ROS/RNS und/oder eine verminderte Effizienz physiologischer antioxidativer Abwehrsysteme zurückzuführen sind ), Entzündungen/Infektionen, Schwermetalle, Zigarettenrauchen, Umweltverschmutzung, unzureichende körperliche Bewegung und sind die Ursache für degenerative Erkrankungen, Herz-Kreislauf-Erkrankungen, Zellalterung, Karzinogenese, Arteriosklerose, Katarakte, Parkinson/Alzheimer, Lungen- und Gefäßerkrankungen, Diabetes und Alterung.
I Phenolische Verbindungen (PC) von nativem Olivenöl (VOO) haben eine antioxidative Wirkung, sowohl in vivo als auch in vitro, insbesondere die Tocopherol, die Oleuropein-Aglycon und seine Ableitung Hydroxytyrosol (TyOH).
Diese Aktivität hängt mit der Molekülstruktur zusammen, in der der Phenolring ein Wasserstoffatom (der –OH-Gruppe) an freie Radikale abgeben kann, wodurch die oxidative Kette unterbrochen wird (Kettenbruch); Der Ring wiederum wird zu einem stabileren Radikal, das der neuen elektronischen Struktur des ungepaarten Elektrons des Wasserstoffs widersteht und es in den C6-Bindungsorbitalen des Rings selbst delokalisiert. In TyOH, dessen Phenolring über zwei Hydroxylgruppen verfügt, schwächt das Vorhandensein der zweiten Gruppe die Dissoziationsenergie der -OH-Bindung der ersten Gruppe und führt daher zu einer leichteren Abgabe von Wasserstoffatomen und einer stärkeren antioxidativen Wirkung, auch im Vergleich zu Tyrosol und Derivaten .
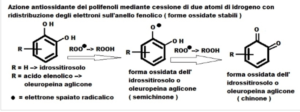
Die abfangende Wirkung (Fänger freier Radikale) von PCs wandelt freie Radikale in nicht-radikalische Verbindungen um, die keine Reaktivität und daher keine Toxizität für Zellstrukturen aufweisen, wie z. B. die Oxidationsfähigkeit von: Membranlipoproteinen, DNA (verbunden mit Onkogenese), Plasma-Lipoproteinen LDL (verbunden mit Atherosklerose). ), Neuronen (im Zusammenhang mit Alzheimer und Parkinson), Strukturen als Ursache von Diabetes und chronisch degenerativen Erkrankungen…
PCs widerstehen nach der Einnahme der Wirkung von Magensäften, werden schnell im Darm absorbiert und gelangen über den enterohepatischen Kreislauf in die Leber, wo sie in einem (enzymatischen) Veresterungsprozess der beiden phenolischen Gruppen (-OH) konjugiert werden. , in glucuronidierter und/oder sulfatierter Form. Die hepatische Konjugation dient dazu, PCs, Xenobiotika für den Organismus, besser löslich und über die Nieren ausscheidbar zu machen. In konjugierter Form finden wir sie in sehr geringer Konzentration im Plasma und werden dann innerhalb kurzer Zeit aus dem Harnsystem ausgeschieden. Die Plasmakonzentration der Konjugate ist viel niedriger als bei anderen Antioxidantien (Harnsäure, Bilirubin, Vitamin C und E...), außerdem ist die Menge, die in die Zellen transportiert werden kann, minimal, selbst wenn im Zytoplasma ein Enzym vorhanden ist, das dies kann deglucuronidieren die PCs und machen ihre phenolischen Gruppen wieder aktiv.
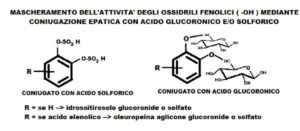
Wir fragen uns, wie phenolische Verbindungen eine antioxidative Wirkung haben können, wenn die Konzentration so gering ist (von Mikromol bis Nanomol/g Gewebe) und was noch schlimmer ist, wenn das phenolische aktive Zentrum für die Konjugation blockiert ist? Wie können diese verschwindend geringen Konzentrationen das direkte endogene zelluläre Redoxsystem beeinflussen?
Aktuelle Kenntnisse über menschliche DNA und Omics-Studien (Nutrigenomik, Transkriptomik, Epigenomik, Proteomik, Metabolomik) haben es möglich gemacht zu verstehen, dass Lebensmittel unsere DNA und die Expression einiger Gene verändern können. Im Fall von VOO-PCs können wir je nach Konzentration zwei Aktivitätswege haben: den direkten Weg, wenn dieser hoch ist und zu den Antioxidantien gehört, die Radikale abfangen, während er, wenn er niedrig ist, wie im Zytoplasma- und Plasmabezirk, indirekter Weg. Diese Art der dosisabhängigen Reaktion wird als hormetischer und im Fall von PCs als „positiv hormetischer“ Effekt bezeichnet. Die PC-Moleküle, die ihr Wasserstoffatom aufgegeben haben, werden zu PC-oxidierten (Chinonen oder Semichinonen), die vorübergehenden oxidativen Stress auslösen können, und müssen entsorgt werden, um zu verhindern, dass andere Grundstrukturen durch freie Radikale beschädigt werden. Folglich können sie ein Hochregulierungssignal endogener antioxidativer Enzyme auslösen, das die Zelle auf ein höheres Schutzniveau gegen die schädlichen Auswirkungen von oxidativem Stress bringen kann. Die oxidierten Pcs binden, nachdem sie in die Zelle gelangt sind, an den Keap1-SH–Nrf2–Keap1-SH-Komplex. Diese Bindung führt zur Oxidation der Thiolgruppen (-SH) unter Bildung von Keap1-SS – SS-Keap1, der Transkriptionsfaktor Nrf2 wird freigesetzt, der in den Zellkern wandert und an die 16 Basen lange DNA-Sequenz (5'-TA/CA) bindet -nn-ATGA-C/T-nnn-GCA-3', wobei n = eine beliebige Base), genannt ARE (Antioxidant Response Element), aktiviert die Gene, von denen Boten-RNAs transkribiert werden und die von der Zelle daher eine Reihe antioxidativer und entgiftender Enzyme synthetisiert werden Phase II des Oxidoreduktasewegs als Reaktion auf schädliche Reize. Die Antwort ist die erhöhte Aktivität von Enzymen wie Plasma-GPX (Glutathionperoxidase – baut Peroxide ab), Erythrozyten-CAT (Katalase – baut Peroxide ab) und Plasma-GSH (reduziertes Glutathion – starkes Antioxidans, das zu GSSG oxidieren kann) und anderen antioxidativen Enzymen . Wir dürfen nicht vergessen, dass der Kernfaktor Nrf2 neben der Aufrechterhaltung der zellulären Redoxhomöostase, der Entgiftungswirkung (Arzneimittelstoffwechsel), dem Hämoglobinstoffwechsel der roten Blutkörperchen, dem Lipidstoffwechsel und der Lipogenese, der Gluconeogenese, der Autophagie und der Apoptose (programmierte Zelle) ein wichtiger Punkt ist Tod, Aktivitäten, die zum Verlust von Tumorzellen führen). Endogene, Nrf2-abhängige antioxidative Enzyme schützen die DNA auch vor dem Angriff durch Radikale genotoxischer Chemikalien, die für die Aktivierung von Onkogenen oder Mutationsschäden an der DNA verantwortlich sind.

Wenn die PC-Konzentration im Plasma so niedrig ist und nach der Einnahme nur von kurzer Dauer ist, durch welchen Mechanismus wird die Lipidoxidation von Low-Density-Lipoprotein (LDL) als Vorbeugung gegen Arteriosklerose verhindert? PCs könnten sich im Innenraum von LDL-Partikeln konzentrieren und über einen direkten antioxidativen Mechanismus wirken. Es wurde auch die Hypothese aufgestellt, dass einige Derivatprodukte von Vitamin E (nicht-enzymatischer lipophiler Bestandteil von VOO, der auch in der Zellmembran vorhanden ist und ein starkes „kettenbrechendes“ Antioxidans ist) nach der Übertragung von Wasserstoffatomen Tocopherylmoleküle bilden können. potenziell toxische Chinone und daher in der Lage, die Genantwort zu stimulieren, wie die analogen Chinonverbindungen, die von den gerade beschriebenen oxidierten Polyphenolen abgeleitet sind.
Bibliographie
Piroddi M. et al. Nutrigenomik von nativem Olivenöl extra: Ein Rückblick. 2016, Wiley Online Library;43,17-41; doi:10.1002/biof.1318
Ma Q. Rolle von Nrf2 bei oxidativem Stress und Toxizität. Jahr 2013. Rev. Pharmacol. Toxicol.,53;401-426; doi:10.1146/annurev-pharmtox-011112-140320
Rodriguez-Morato J. et al. Mögliche Rolle von phenolischen Verbindungen in Olivenöl bei der Prävention neurodegenerativer Erkrankungen. 2015: Moleküle; 20, 4655-4680; doi:10.3390/molecules20034655
Vujovic A. Olivenöl zwischen Geschichte und Wissenschaft. 2020;S. 439-440; Herausgeber Tozzuolo Perugia. Bereits veröffentlicht hier



















