L’oleaceina e l’oleocantale sono due biofenoli dell’olio extravergine di oliva di qualità che possono modulare l’infiammazione, le malattie neurodegenerative, tra le quali l’Alzheimer (AD, Alzheimer Disease), ed il cancro, azioni dimostrate con studi sia su cellule che su animali.
L’oleaceina e l’oleocantale sono due biofenoli dell’olio extravergine di oliva di qualità che possono modulare l’infiammazione, le malattie neurodegenerative, tra le quali l’Alzheimer (AD, Alzheimer Disease), ed il cancro, azioni dimostrate con studi sia su cellule che su animali.
L’oleaceina (Olea) deriva dall’oleuropeina, mentre l’oleocantale (Oleo) dal ligstroside, entrambi contenuti nell’oliva, ed appartengono alla famiglia dei secoiridoidi; sia Oleo che Olea posseggono un “gruppo dialdeidico” che rende queste molecole molto reattive.
È stato anche evidenziato che, quando queste molecole vengono iniettate nell’animale da esperimento, scompaiono rapidamente; lo stesso fenomeno avviene quando vengono aggiunte ai terreni delle coltura cellulari.
Gli studi di farmacocinetica hanno riscontrato difficoltà a studiarle, perché i gruppi dialdeidici reagiscono prontamente con le amine primarie presenti nei liquidi biologici (aminoacidi, proteine, peptidi, poliammine, plasma…) e nei terreni di coltura delle cellule per formare un addotto tetraidropiridinico (base di Schiff) (1).
Quindi è sorto il dubbio se gli effetti biologici siano legati alle molecole dialdeidiche, cioè le progenitrici, oppure alle molecole derivate dalla reazione con le amine primarie, sia biogene che non biogene.
Lo studio di Daniel Di Risola e Coll. (2) ha dimostrato che l’oleaceina e l’oleocantale reagiscono velocemente con una amina primaria, non biogena, utilizzata, molto di frequente, in laboratorio per il suo effetto tampone [(tris (idrossimetil) amminometano, acronimo Tris)] formando Tris-Oleaceina (Tris-Olea) e Tris-Oleocantale (Tris-Oleo).
Questo studio ha poi dimostrato, con opportuni substrati, che i derivati della reazione, cioè Tris-Olea e Tris-Oleo, mantengono la loro capacità antiossidante e antinfiammatoria.
Precedenti studi avevano documentato che nell’Alzheimer le mutazioni delle proteine Tau o anche la loro iperfosforilazione anormale, generano filamenti Tau che possono assemblarsi tra di loro e formare grovigli tipici della malattia.
La funzione normale delle proteine Tau è quella di stabilizzare i microtubuli intracellulari del citoscheletro delle fibre nervose e di perseguire il trasporto delle molecole dal corpo del neurone fino alla sinapsi.
Inoltre, i microtubuli in condizioni fisiologiche servono per espellere dalle cellule proteine tossiche.
L’iperfosforilazione delle Tau porta ad una modifica sterica della proteina, che da lineare diventa pieghettata; in questa fase è essenziale la sequenza per formare aggregati patologici, da qui i grovigli neurofibrillari.
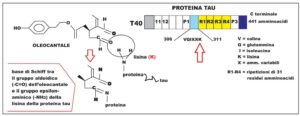
L’oleocantale inibisce la formazione di fibrille Tau nelle taupatie, modificando questo esapeptide 306-VQIXXK-311 (PHF-6). Questi sei amminoacidi Tau, normalmente non consentono l’aggregazione delle fibrille, ma quando sono iperfosforilati si aggregano e danneggiano i neuroni con la formazione di placche amiloidi.
L’iperfosforilazione della proteina Tau determina una modifica da un punto di vista conformazionale trasformandola da proteina lineare (tipo a matita) a proteina pieghettata (tipo a tetto ondulato).
L’oleocantale si lega, con la sua parte dialdeidica, al gruppo epsilon-amminico della lisina per dare la tipica reazione chimica delle immine secondarie o “basi di Schiff”, con l’eliminazione di molecole di acqua.
Questa reazione tra Oleo e proteina Tau è stata confermata mediante analisi con spettrometria di massa con desorbimento / ionizzazione laser a matrice assistita.
Gli studi molecolari hanno evidenziato che per la sua funzione, l’Oleo debba avere i suoi due gruppi aldeidici ad anello aperto funzionali.
Questa conformazione, ad anello aperto, è quella che normalmente determina all’olio EVO la sensazione gustativa di pungenza nell’orofaringe, tipica di alcune cultivar ricche di biofenoli.
In pratica l’Oleo, legandosi alla sequenza aminoacidica iperfosforilata della proteina Tau inibisce la possibilità che questa si leghi ad altre proteine Tau per formare una struttura plissettata.
Nell’Alzheimer l’Oleo aumenta anche, attraverso la barriera ematoencefalica, l’eliminazione dall’encefalo, delle proteine ADDL (Amiloid beta Derivated Diffusible Ligands) che sono la causa, dell’iperfosforilazione delle proteine Tau.
Inoltre l’oleocantale impedisce l’oligomerizzazione delle ADDL (cioè la formazione di ammassi di oligomeri ADDL quale causa delle placche amiloidi)(3).
Lo studio di Daniel Di Risola e Collaboratori, conferma l’ipotesi di Darakjian e colleghi, su questo legame tra i due secoiridoidi e le ammine primarie, nel contempo apre un nuovo quadro interpretativo per comprendere le numerose prove riguardanti le proprietà di Olea ed Oleo “in vivo”.
Bibliografia
- Lucy I. Darakjian et al. ACS Pharmacol. Transl. Sci. 2021, 4, 179–192.
- Di Risola D. et al. Molecules 2025, 30(7), 1645; https://doi.org/10.3390/molecules30071645
- Vujovic A. L’olio di oliva tra storia e scienza. 2020, Tozzuolo Editore, Perugia. Cap. 17.17 Effetti neuroprotettivi delle biomolecole dell’EVO nella prevenzione della malattia di Alzheimer. Pg 394-398