 La vita di ogni cellula è regolata da vari “orologi biologici” che controllano l’accrescimento, la morte cellulare programmata (apoptosi) e la degradazione/riutilizzo dei componenti cellulari danneggiati o invecchiati (autofagia).
La vita di ogni cellula è regolata da vari “orologi biologici” che controllano l’accrescimento, la morte cellulare programmata (apoptosi) e la degradazione/riutilizzo dei componenti cellulari danneggiati o invecchiati (autofagia).
Grazie al contributo del biologo cellulare Yoshinori Ohsumi, premio Nobel per la medicina nel 2016, è stato possibile comprendere il ruolo dell’autofagia nella fisiologia e, significativa è la sua dichiarazione al momento del premio: “il corpo umano vive attraverso questo processo di autodecomposizione, che è una forma di cannibalismo, il mantenimento di un equilibrio delicato fra costruzione e distruzione cellulare. Questo è quello che in fondo caratterizza la vita, riciclarsi e rinnovarsi continuamente per eliminare tutto ciò che è danneggiato o non più funzionante”.
Masaaki Komatsu del gruppo Kominami (Cell.2007;131:1149–63) ha dimostrato che alterazioni del processo di autofagia portano all’ipertrofia e alla formazione dei tumori; altri autori hanno indicato che sono causa di diabete, m. Parkinson, m. Alzheimer e m. Huntington.
La base di molte malattie neurodegenerative è la formazione di proteine anomali (dispiegate, malripiegate o aggregate) all’interno della cellula.
Nel m. di Parkinson si ha l’accumulo anomalo di inclusioni proteiche, insolubili, all’interno dei neuroni, i cosiddetti corpi di Lewy, che danneggiano le cellule dell’area dopaminergica dell’encefalo, la substantia nigra di Sommering.
Nell’Alzheimer sono presenti ammassi di grovigli neurofibrillari di proteina Tau e placche amiloidi di β-peptide.
Nella m. di Huntington è presente una proteina mutata, l’huntingtina (poliglutammina) che ottura i pori cellulari e impedisce il passaggio di altre molecole.
In seguito al danno, la cellula induce, rapidamente, l’autofagia come meccanismo di sopravvivenza, nel tentativo di rimuovere le proteine danneggiate. L’autofagia è indotta anche da carenza di glucosio, di nutrienti, di fattori di crescita, di energia chimica (come l’ATP, l’adenosintrifosfato), nell’ischemia, nello stress e nell’ipossia.
Se il danno è troppo grave, viene indotta l’apoptosi mentre l’autofagia diventa un «vero» meccanismo di morte quando l’apoptosi non funziona. L’autofagia interviene per rimuovere le cellule o gli organuli danneggiati, anche nella chemioterapia oppure per la presenza di patogeni intracellulari o in mancanza di nutrienti/fattori di crescita. Come causa generale d’invecchiamento è ampiamente accettato l’accumulo di danni cellulari, tempo-dipendente (cioè progressivi con il tempo).
Il danno cellulare può occasionalmente provocare vantaggi aberranti ad alcune cellule, che, eventualmente, possono dar origine al cancro. Quindi, cancro e aging possono essere viste come due diverse manifestazioni dello stesso processo di base, cioè l’accumulo di danni cellulari.
Le cellule tumorali evolvono con strategie multiple per eludere l’apoptosi mediante mutazioni genetiche o modifiche epigenetiche.
Difetti dell’apoptosi, dell’autofagia e della necroptosi portano alla progressione metastatica dei tumori. Cioè l’autofagia ha anche un ruolo antimetastatico nei tumori (Su Z. et Coll. 2015 Mol Cancer. 14: 48).
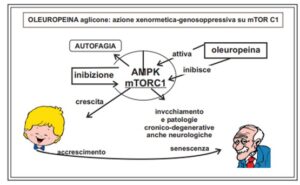
L’efficienza dell’autofagia diminuisce con l’età con conseguente accumulo di aggregati proteici nocivi e di mitocondri danneggiati che portano all’insorgenza di patologie cronico-degenerative, anche neurologiche. Nella cellula esiste una complessa rete di molecole che attivano e/o inibiscono l’autofagia; l’omeostasi dipende dalla via di segnalazione AMPK/mTORC1.
Il gene mTORC1 (Mammalian Target Of Rapamycin Complex 1 = complesso proteico enzimatico – una protein-chinasi- è il bersaglio della rapamicina nei mammiferi), è deputato alla crescita e sopravvivenza cellulare, della riproduzione, della maturazione, della sintesi proteica, della trascrizione e della motilità.
Il complesso mTORC1, deputato alla crescita, inibisce l’autofagia, che in pratica è l’operazione inversa.
Dopo la maturità e l’età feconda, l’mTOR diventa inadeguato ed eccessivo quindi responsabile delle iperproduzioni cellulari, come in alcune malattie cronico degenerative, presenti poi sia nell’invecchiamento fino alla cancerogenesi.
Molti autori sono concordi che l’invecchiamento può essere considerato come un fenomeno programmato guidato dall’iperattività del gene mTOR (gerogene) e da un declino dell’AMPK (gerosoppressore).
È stato dimostrato, su animali da esperimento, che la soppressione di mTOR aumenta la durata della vita.
Questo gene ha come modulatore/inibitore il gene AMPK [Adenosine Monophospate-Activated Protein Kinase, cioè un complesso proteico, chinasi dipendente dall’adenosina monofosfato (AMP)].
Il gene AMPK è sensibile all’energia alimentare assunta, in pratica al rapporto (AMP+ADP/ATP); [AMP = adenosina monofosfato, ADP adenosina difosfato, APT adenosina trifosfato; ATP>ADP+P> AMP+PP; l’ATP è una molecola fosforilata ricca di energia, in pratica libera 10,9 Kcal/mole quando passa ad AMP].
È fondamentale l’omeostasi del rapporto AMPK / mTOR; alcune condizioni lo migliorano come la restrizione calorica, il digiuno e una moderata attività motoria.
L’oleuropeina aglicone, con tenuta nell’olio di oliva di qualità, migliora questo rapporto mediante un processo di xenormesi (xenos = estraneo riferito all’oleuropeina; l’ormesi è una risposta a due fasi, quando la concentrazione della molecola è bassa determina uno stimolo stressogeno, benefico, mentre a dosi elevate porta ad effetti avversi).
L’assunzione di olio di oliva di qualità (EVOO) determina una concentrazione intracellulare di polifenoli estremamente bassa quindi l’effetto è sempre benefico, ed è migliore se il consumo è costante nel tempo.
Diversi studi hanno dimostrato l’azione protettiva di alcuni polifenoli, tra cui l’oleuropeina aglicone (EVOO), il resveratrolo (vino), curcumina, quercetina (cipolle e capperi), genisteina (soia), epigallocatechin-gallato (tè verde), che possono inibire l’accumulo di proteine aggregate tossiche per la cellula come le proteine Tau ed i depositi di peptide β-amiloide, in determinate aree del cervello, ad es. nella m. di Alzheimer.
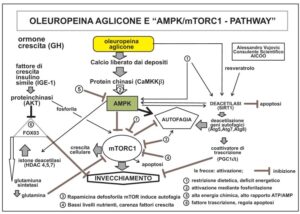
L’oleuropeina aglicone ha un effetto pleiotropico sull’induzione dell’autofagia agendo su vari meccanismi nucleari (maggiori informazioni in fig. 2 Cordero J.G 2018) determinando tra le tante attività anche quella neuroprotettiva, su modelli animali. Quest’ultima è determinata dall’inibizione della formazione di aggregati tossici proteici nelle cellule del tessuto nervoso modulando epigeneticamente l’acetilazione degli istoni legati al DNA ma soprattutto stimolando l’autofagia mediante l’attivazione di AMPK, che induce la sintesi di glutamina sintetasi, che a sua volta aumenta la glutamina, potente inibitore di mTORC1.
L’AMPK agisce su numerosi fattori di trascrizione relativi al controllo metabolico e sull’autofagia.
L’oleuropeina aglicone ha un’attività capace di aumentare, a livello molecolare, il rapporto AMPK/mTORC1 elevando i livelli di calcio citosolico dai depositi dell’ergastoplasma che attivano e fosforilano il complesso enzimatico AMPK il quale inibisce, fosforilando, mTORC1 con conseguente autofagia degli aggregati proteici dannosi.
L’attività gerosoppressiva dell’oleuropeina su mTORC1 è simile a quella della rapamicina. Questo è un antibiotico isolato dal batterio presente nel suolo (Streptomyces hygroscopicus) dell’isola di Pasqua (isola Rapa Nui da cui deriva il nome), capace di sopprimere il sistema immunitario (è un immunosoppressore utilizzato nei trapianti di organi), antimicotico, antinfiammatorio, antitumorale ed è un potente inibitore del gerogene mTOR capace, quindi, di rallentare l’invecchiamento cellulare.
Va anche precisato che l’oleuropeina aglicone, contenuta nell’EVOO, è rappresentata da un equilibrio di molecole in differenti forme tautomeriche, intendendo con questo termine molecole dove il trasferimento di un protone, il cosiddetto idrogeno alfa, trasforma un’aldeide o un chetone in un “enolo” (ad es. enolaldeidiche, emiacetaliche, dialdeidiche). Di queste forme, di oleuropeina, la maggior capacità antiaggregante sulle proteine Tau, dimostrata in vitro, è legata alle forme aldeidiche.
Il gruppo franco-belga di ricerca, diretto da Anthony Daccache, ha riportato che in futuro queste molecole contenute nell’olio di oliva potrebbero essere utilizzate come farmaci nelle taupatie neurodegenerative collegate al declino cognitivo, come nell’Alzheimer.
Bibliografia
– Cordero J.G. et al. 2018. Benefit of Oleuropein Aglycone for Alzheimer’s Disease by Promoting Autophagy. Hindawi Oxidative Medicine and Cellular Longevity, Vol. 2018, Article ID 5010741, 12 pages. DOI:org/10.1155/2018/5010741
– Menendez J.A. et al. 2013. Xenohormetic and anti-aging activity of secoiridoid polyphenols present in extra virgin olive oil: a new family of gerosuppressant agents. Cell Cycle;12 (4):555-78. DOI: 10.4161/cc.23756
– Casamenti F. et al. 2014, Oleuropein Aglycone: A Possible Drug against Degenerative Conditions. In Vivo Evidence of its Effectiveness against Alzheimer’s Disease. J. of Alzheimer’s Disease; 45, 3, 679-88. DOI: 10.3233/JAD-142850
– Ohsumi Y.2014. Historical landmarks of autophagy research. Cell Research; 24, 9–23 DOI:10.1038/cr.2013.169
– Hasima N. et Coll. 2014. Regulation of autophagy by polyphenolic compounds as a potential therapeutic strategy for cancer. Cell Death Dis; 5:e1509. DOI: 10.1038/cddis.2014.467.
– Su Z. et al. 2015, Apoptosis, autophagy, necroptosis, and cancer metastasis. Mol Cancer, 14: 48.
– Vujovic A. L’olio di oliva tra storia e scienza. 2020, Tozzuolo Editore, Perugia. Cap. 17.28; pg 431-435.
– Vujovic A. su T.N. 04/2018.
– Daccachea A. et al. 20112, Oleuropein and derivatives from olives as Tau aggregation inhibitors. Neurochemistry Inter. 58; 700–707.
DOI:10.1016/j.neuint.2011.02.010.


















